膝关节骨性关节炎(Knee Osteoarthritis, KOA)是一种以膝关节软骨退行性病变为主要病理表现的一种退行性疾病。据统计,到2050年,KOA的发病率将增加75%且影响着全球30岁以上人群中15%的人口。然而,KOA软骨厚度虽仅3-5毫米,但其呈现清晰可见的表、中、深3层空间结构。已有研究表明,软骨细胞在正常状态下呈现出多种细胞表型,且在病态条件下更是呈现出“千姿百态”。
但目前仍缺少系统、全面的软骨细胞图谱景观且软骨细胞的空间分布状态仍未知。近年来,高通量单细胞组学与空间组学测序技术的成熟与发展,为研究者们从多维度、多层面探究KOA异质性问题提供了可能。
近日,西安交通大学医学部孙世权教授团队联合中国科学院广州生物医药与健康研究院彭广敦研究员团队在《风湿病年鉴》(Annals of the Rheumatic Diseases,IF = 27.4)发表了题为《多组学数据整合揭示炎症和前肥大细胞群在骨关节炎膝关节软骨退变中的关键作用》(Unveiling inflammatory and prehypertrophic cell populations as key contributors to knee cartilage degeneration in osteoarthritis using multi-omics data integration)的研究论文。该研究从软骨细胞、软骨组织、KOA人群三个层面,整合了单细胞、空间以及全基因组关联分析(GWAS)等多模态数据,构建软骨细胞分群或状态图谱景观、明确KOA关联细胞群或亚群、确定KOA患者亚型、提供KOA疾病相关标志物和单细胞分辨率易感位点,为揭示KOA发病机制提供新视角。
为了建立膝关节骨性关节炎患者和正常对照软骨细胞的细胞图谱景观,作者首先对8例骨关节炎患者中承重区(磨损严重区域,WB)与非承重区(轻度磨损区域,NWB),以及3例正常对照个体膝关节软骨进行了scRNA-seq单细胞转录组测序(10X Genomics)分析,研究发现前肥大软骨细胞(preHTC)、纤维软骨性软骨细胞(FC)、稳态性软骨细胞(HomC)在患者与正常软骨中存在丰度差异性。此外,作者还发现了2种新的稀少软骨细胞:炎性软骨细胞(InfC)和前炎性软骨细胞(preInfC)。
这两种细胞类型仅分别占细胞总数的1.1%和0.39%,且显著富集于KOA患者软骨组织中。另外,作者还发现preHTC不仅在细胞组成比例中具有最大的差异,而且在转录水平上也显示出了最大的差异,提示preHTC可能是引起KOA的关键细胞群。

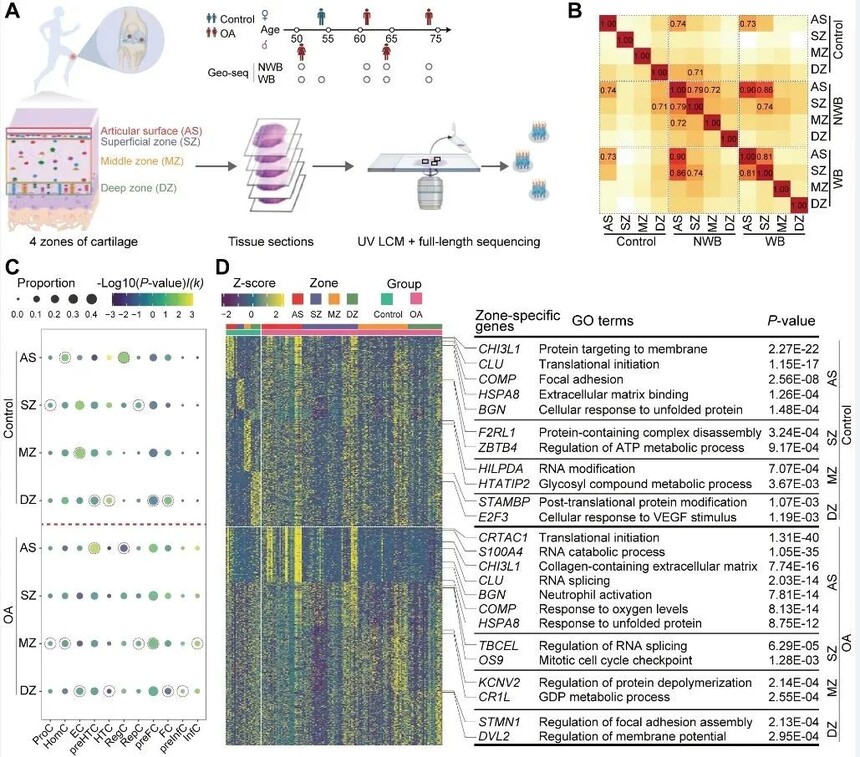
为了建立膝关节骨性关节炎患者和正常对照软骨细胞的空间不同分层细胞景观,作者随后对4例骨关节炎患者中承重区(磨损严重区域,WB)与非承重区(轻度磨损区域,NWB),以及1例正常对照样本膝关节软骨进行了空间转录组测序(Geo-seq)数据分析,即对软骨组织中的软骨膜(AS),表层(SZ),中层(MZ)及深层(DZ)的软骨细胞进行测序分析,构建了KOA患者与正常对照膝关节软骨的空间转录组图谱。
依靠Geo-seq对硬组织的分析能力,研究发现:相比于软骨中层与深层,KOA患者的软骨膜与软骨表层软骨细胞表现更强的转录异质性。此外,前肥大软骨细胞(preHTC)与前纤维软骨性软骨细胞(preFC)显著富集于KOA患者软骨的表层。
进一步地,作者通过软骨细胞交互分析,发现KOA患者与正常对照的主要差异集中在由前炎性软骨细胞(InfC)激活的多种KOA特异性炎性相关信号通路。具体来说,KOA软骨细胞会分泌更多的巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)分子,这些MIF分子与InfC表面的CD74、CXCR2、CXCR4等MIF受体结合,激活MIF-CD74信号通路。这一信号通路的激活会进一步激活下游信号通路并最终导致KOA患者软骨组织的炎症反应。
实时定量PCR(Real-time PCR)结果显示MIF、CD74以及炎性细胞因子IL1β和TNF在KOA软骨组织中表达上调。进一步,作者通过病毒转染技术在原代软骨细胞中过表达CD74基因,发现CD74的高表达可以在软骨细胞中诱导炎性细胞因子IL1β和TNF表达上调,提示CD74可能是引发软骨细胞炎症反应的重要因素。

最后,作者将scRNA-seq数据与传统(Bulk)转录测序数据进行整合分析,发现preHTC无论在细胞丰度水平、还是转录差异水平,均与KOA状态显著相关,且具有较高的疾病状态预测精度(AUC = 0.99)。
此外,作者通过去卷积分析,针对131例KOA患者的传统转录测序数据鉴定出两种KOA亚型:一种为炎症相关亚型(Group A);另一种为软骨细胞纤维化相关亚群(Group B)。进一步,作者对scRNA-seq数据与全基因组关联分析(GWAS)数据进行整合分析,发现欧洲人群与亚洲人群的GWAS关联基因均主要富集于肥大软骨细胞群(HTC),提示遗传因素可能通过影响HTC的稳定性,从而导致KOA的发生。
该研究通过scRNA-seq、Geo-seq、RNA-seq、GWAS等数据整合分析,绘制了KOA和正常对照软骨的细胞景观图谱,从单细胞分辨率层面解析了KOA患者与正常对照膝软骨细胞之间的差异特征,明确了KOA相关的preHTC、InfC两种软骨细胞亚群及其标志物,发现了介导遗传变异与KOA的关键细胞群,为KOA个性化防诊治体系构建提供了新思路。本文中的测序数据均可公开下载使用,链接详见文内。
西安交通大学医学部樊越(助理研究员)、边煦朝(博士生)、中科院广州生物医药与健康研究院孟小高(博士生)为该论文的共同第一作者。西安交通大学医学部孙世权教授和中国科学院广州生物医药与健康研究院彭广敦研究员为该论文的共同通讯作者。该研究成果受到了国家自然科学基金优秀青年基金项目、科技部重点研发计划项目、国家自然科学基金项目、广州国家实验室专项项目等资助。
论文链接;https://ard.bmj.com/content/early/2024/02/07/ard-2023-224420.abstract