|
上海肺科医院与中科院合作绘制小细胞肺癌蛋白基因组学图谱,系统揭示疾病分子特征并提出个性化治疗新策略肺癌是全球范围内最常见的恶性肿瘤。在我国,肺癌的发病率和死亡率均居各类恶性肿瘤之首,且呈持续上升态势【1,2】。按照病理类型,肺癌可以分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌。小细胞肺癌约占肺癌总数的15%,是所有肺癌亚型中恶性程度最高、预后最差的亚型,其5年生存率仅为5%【3】。小细胞肺癌的主要特点是生长迅速、转移率高,且极易耐药,在病理表型、生物学特征及治疗选择上都与非小细胞肺癌形成鲜明对比。小细胞肺癌患者并未受益于靶向治疗,尽管免疫治疗在小细胞肺癌领域取得一定突破,但临床上获益于免疫治疗的患者仍十分有限。分子表征与组学研究的不足极大地限制了小细胞肺癌的基础和临床进展,迄今为止,仅有少量针对小细胞肺癌临床样本的基因组研究被报道【4,5】。但由于小细胞肺癌普遍存在TP53和RB1的失活突变,缺乏驱动突变,使得难以通过基因突变信息获得有效靶点和分子分型。
近年来,以蛋白质组为核心的临床大队列样本多组学研究策略通过构建肿瘤分子图谱全景,全面系统揭示了多类肿瘤的分子特征及潜在治疗策略。例如,在肺癌领域,2020年,三项肺腺癌蛋白基因组学研究同期发表【6-8】;2021年临床蛋白质组肿瘤分析联盟(Clinical Proteomic Tumor Analysis Consortium,CPTAC)报道了肺鳞癌的蛋白基因组学图谱【9】。这些研究为后续深入揭示非小细胞肺癌的分子特征以及新型诊疗策略的开发奠定了坚实的理论基础。因此,在难以通过基因突变信息获得有效治疗靶点和分子亚型的背景下,全面系统地解析小细胞肺癌的蛋白质组学特征,将有利于深入理解小细胞肺癌的病理机制,阐明小细胞肺癌发生发展过程的生物学事件,对于实现更精准的小细胞肺癌分子分型和个性化治疗具有重要科学意义。
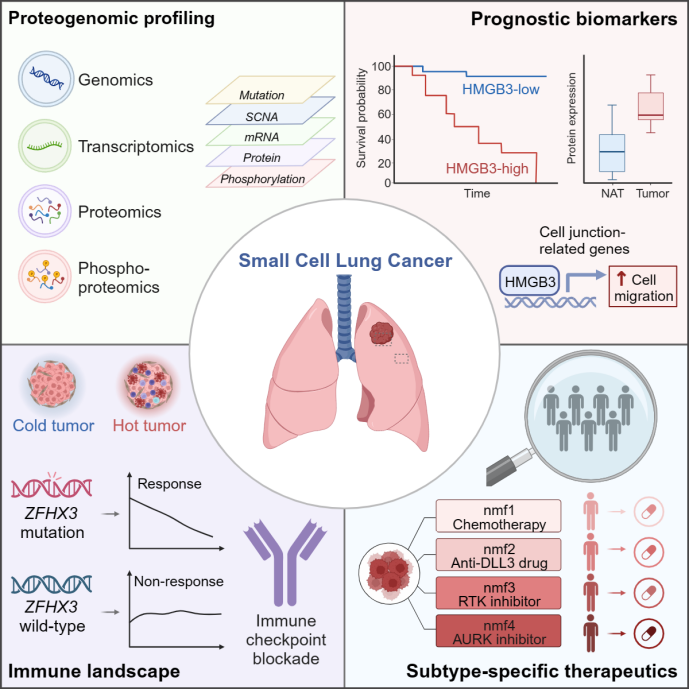
2024年1月4日,同济大学医学院/附属上海市肺科医院张鹏教授团队、中国科学院上海药物研究所周虎研究员团队与中国科学院分子细胞科学卓越创新中心季红斌研究员团队、高大明研究员团队合作在Cell发文,题为“Proteogenomic Characterization of Small Cell Lung Cancer Identifies Biological Insights and Subtype-Specific Therapeutic Strategies”的最新成果,在国际上首次大规模对小细胞肺癌临床队列开展蛋白质组和磷酸化蛋白质组表征,全面绘制了小细胞肺癌蛋白基因组学图谱,系统揭示了小细胞肺癌的分子特征,提出新的分子分型及其针对性的个体化治疗策略,为深入理解小细胞肺癌的发病机制及其临床治疗策略的改善奠定了坚实的基础。
在这项研究中,研究人员收集了来自同济大学医学院/附属上海市肺科医院的小细胞肺癌患者的肿瘤及配对癌旁组织,并进行了全外显子组、转录组、蛋白质组及磷酸化蛋白质组的多组学整合分析。研究发现,TP53和RB1的体细胞突变及拷贝数缺失是小细胞肺癌的主要基因变异,而与西方人群相比,中国人群ZFHX3的突变频率较高。整合多组学数据表明,TP53,FAT1和GNAS的突变对自身表达产生影响,且FAT1突变可通过促进细胞EMT表型加速小细胞肺癌的发生发展。拷贝数变异对mRNA和蛋白质表达存在顺式及反式调控作用,RB1缺失在蛋白质水平表现出显著的反式效应,而对mRNA影响较小;其次,染色体5q缺失通过反式效应调控DNA合成、DNA损伤修复及细胞周期相关的蛋白质表达,可能是小细胞肺癌发生发展的重要机制。
其次,对肿瘤组织和配对癌旁组织的蛋白质组学特征进行对比分析,研究人员发现了一系列与小细胞肺癌发生发展密切相关的蛋白质、磷酸化位点及活性显著变化的激酶(CHEK1、ATR、ATM、CDK2、GSK3A)。结合患者生存信息,研究人员鉴定到两个与预后显著相关的蛋白质HMGB3和CASP10,HMGB3在肿瘤中显著高表达,其表达越高则预后越差;CASP10在肿瘤中显著低表达,其低表达与不良预后相关。独立临床队列的免疫组化分析证实了HMGB3和CASP10表达与预后的相关性,提示其具有潜在的临床预后指示价值。进一步生物学实验表明,HMGB3可通过转录调控细胞连接 (cell-junction) 相关基因表达促进小细胞肺癌的细胞迁移。
随后,研究人员对小细胞肺癌的免疫微环境特征进行了系统分析,并根据免疫细胞浸润水平进行免疫分型,发现大多数小细胞肺癌属于冷肿瘤(“cold-tumor enriched”亚型)且预后较差;仅有少数肿瘤免疫细胞浸润水平较高,属于热肿瘤(“hot-tumor enriched”亚型),该类肿瘤同时具有interferon-gamma通路、抗原呈递等免疫相关通路的激活,及免疫检查点(如CTLA4、PD-L1、PD-1)分子表达的上调,提示这部分患者可能受益于免疫治疗。通过多组学整合分析,研究人员还发现ZFHX3突变在热肿瘤中显著富集,与免疫细胞浸润水平升高密切相关。更重要的是,在接受PD-1或PD-L1抑制剂联合化疗的小细胞肺癌临床试验患者肿瘤样本中,研究人员证实了ZFHX3突变患者具有更好的治疗响应,提示ZFHX3突变或可作为小细胞肺癌免疫治疗受益的生物标志物。
最后,研究人员利用多组学数据基于非负矩阵分解算法将小细胞肺癌分为四个亚型(nmf1-4),系统表征了各亚型独特的分子特征并提出潜在治疗策略。其中,nmf1为经典亚型,表现为增殖快、E2F活性高、复制压力高,提示可能受益于基于顺铂+依托泊苷的一线化疗方案;nmf2亚型肿瘤表现出显著升高的DLL3表达,提示可能受益于靶向DLL3的治疗方案;nmf3亚型肿瘤在磷酸化蛋白质组层面表现出受体酪氨酸激酶(RTK)通路的显著激活,提示可能受益于靶向RTK的治疗方案;nmf4亚型患者表现出特异性升高的MYC表达及MYC通路激活,提示可能受益于极光激酶(AURK)抑制剂。研究人员还建立了大规模的患者样本来源肿瘤的小鼠移植瘤(PDX)模型和人小细胞肺癌细胞系来源的小鼠移植瘤(CDX)模型,并对其进行基因组学和蛋白质组学整合分析,在进行类似的分子分型的基础上验证了基于临床样本分子分型的针对性治疗策略。
总的来说,这项工作是国际上首次大规模对小细胞肺癌临床队列开展蛋白质组和磷酸化蛋白质组表征,这些研究成果为小细胞肺癌的病理机制解析、预后检测、分子分型及个性化治疗提供了理论依据,同时产生的高质量大数据将为广大小细胞肺癌基础与临床研究者提供支持,推动小细胞肺癌研究领域的发展。
同济大学医学院/附属上海市肺科医院张鹏教授、中国科学院上海药物研究所周虎研究员、中国科学院分子细胞科学卓越创新中心季红斌研究员和高大明研究员为该文共同通讯作者。同济大学附属上海市肺科医院/上海药物研究所刘倩博士、上海市肺科医院章靖博士、中国科学院分子细胞科学卓越创新中心郭晨晨博士、博士研究生王梦成、同济大学生命科学与技术学院王晨飞教授为该文共同第一作者。
原文链接:https://doi.org/10.1016/j.cell.2023.12.004 张鹏教授,博士生导师,主任医师,同济大学长聘教授,国家自然科学基金杰出青年、优秀青年获得者,上海市科委“优秀学术带头人”(青年),上海市卫健委“优秀学科带头人”。张鹏教授课题组一直致力胸部疾病的精准化综合治疗及免疫微环境分子调控机制研究,对于局部晚期肺癌的新辅助治疗和辅助治疗有独到的见解。发起和参加了多项非小细胞肺癌的免疫新辅助和靶向新辅助临床研究,以及小细胞肺癌的免疫新辅助临床研究,取得了良好的临床治疗效果。近年来,该团队在Cell(2024)Cancer Cell(2023)、Immunity(2023)、Nature Communications(2021,2023)、Genome Medicine(2023)、Cancer Research(2023)、Genome Biology(2020)、Nucleic Acid Research(2020)、Journal of Thoracic Oncology(2019)等国际知名期刊上发表系列研究工作。张鹏教授课题组长期招聘博士后,欢迎广大优秀青年人才应聘。
参考文献
1. Chen W, et al. Cancer statistics in China, 2015. CA: A Cancer Journal for Clinicians 2016; 66: 115-32.2. Zhang S, et al. Cancer incidence and mortality in China, 2015. Journal of the National Cancer Center 2021; 1: 2-11.3. Rudin CM, et al. Small-cell lung cancer. Nat Rev Dis Primers. 2021;7(1):3.4. George J, et al. Comprehensive genomic profiles of small cell lung cancer. Nature. 2015;524(7563):47-53.5. Sivakumar S, et al. Integrative Analysis of a Large Real-World Cohort of Small Cell Lung Cancer Identifies Distinct Genetic Subtypes and Insights into Histologic Transformation. Cancer Discov. 2023;13(7):1572-1591.6. Xu JY, et al. Integrative Proteomic Characterization of Human Lung Adenocarcinoma. Cell. 2020;182(1):245-261.e17.7. Chen YJ, et al. Proteogenomics of Non-smoking Lung Cancer in East Asia Delineates Molecular Signatures of Pathogenesis and Progression. Cell. 2020;182(1):226-244.e17.8. Gillette MA, et al. Proteogenomic Characterization Reveals Therapeutic Vulnerabilities in Lung Adenocarcinoma. Cell. 2020;182(1):200-225.e35.9. Satpathy S, et al. A proteogenomic portrait of lung squamous cell carcinoma. Cell. 2021;184(16):4348-4371.e40. 本文转载自“BioArt”公众号 |