|
Cell Rep | 武汉大学周严/刘颖课题组揭示了大脑皮层投射神经元身份建立和维持的表观遗传机制哺乳动物大脑皮层是自然界最为复杂的结构,投射神经元作为主要的功能单位,具有特定形态、电生理、投射模式和基因表达等特征。在发育过程中,大脑皮层各个层次和区域的神经元发生和身份建立受到表观遗传学机制的精密调控,这些机制包括染色质构象及其开放程度、组蛋白修饰和DNA甲基化等。
2023年11月21日,武汉大学医学研究院/免疫与代谢前沿科学中心周严/刘颖课题组在国际学术期刊Cell Reports发表了题为“Histone methylation mediated by NSD1 is required for the establishment and maintenance of neuronal identities”的研究论文。揭示了一个由NSD1介导的调控大脑皮层神经元身份建立和维持的表观遗传机制,增进了对Sotos综合征发病机制的理解。
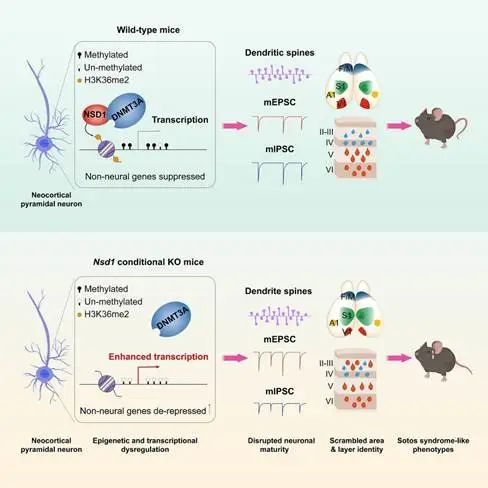
表观调控机制异常与多种神经系统疾病的发生密切相关。Sotos综合征是一种过度生长疾病,由NSD1基因的功能失活突变引起,患者常伴有神经系统异常,包括智力缺陷、学习和认知障碍、自闭症和运动迟缓。NSD1是催化组蛋白H3第36位赖氨酸二甲基化(H3K36me2)修饰的组蛋白甲基转移酶,H3K36me2参与多种细胞类型的DNA从头甲基化。但是,NSD1催化的H3K36me2修饰在大脑皮层发育中的功能以及如何影响神经元身份的建立和维持仍不清楚。
在这项研究中,作者发现在大脑皮层特异敲除Nsd1会导致功能分区异常和皮层-丘脑投射环路建立缺陷。NSD1功能失活小鼠具有空间记忆、运动学习能力和协调性下降等异常行为,模拟了Sotos综合征患者的部分临床表型。此外,NSD1调控大脑皮层神经元身份的建立和维持,在缺失Nsd1的小鼠大脑皮层中,深层标志物CTIP2在浅层异位表达,这在高龄小鼠中更加显著;突变小鼠的神经元处于不成熟状态:其树突棘形态和电生理特性发生了明显改变。NSD1通过其介导的H3K36me2修饰招募甲基转移酶DNMT3A以精密调控谱系相关基因的DNA甲基化,在维持神经元基因表达的同时抑制非神经元基因的表达。当神经元中缺失NSD1后DNA甲基化水平显著降低,尤其是非CG类型的甲基化,导致神经元基因被抑制、非神经元基因异常激活,从而使神经元身份混乱。
机制模式图
论文链接 https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01508-5 |